鳥ボルナ病とはトリボルナウイルスが神経組織に感染することで引き起こされる消耗性疾患/免疫性疾患です。
ダメージを受ける神経組織によっても症状は様々で、症状からの確定診断は困難です。
主な症状としては、毛引き、麻痺、嘔吐、糞減少、進行性の体重減少、臓器機能障害、腺胃拡張症(PDD、ABG)、心血管系、眼、ほか
治療法は確立されておらず対処緩和ケアが主軸になりますが、治療効果がみられた例は少なからずあります。
2020年1月現在においてトリボルナウイルス/鳥ボルナ病についての一般愛鳥家向け解説が見当たらないため自分用の忘備録を掲載しておきます。
※追記表記をした一部以外は原則として2020年1月時点での内容です。
この記事に限らず、信頼度は重要視しておりますが、あくまで個人的な考察による忘備録です。
情報源の多くは論文や専門書であり、外国語は翻訳ツール頼りの主観による補完や意訳も多々あります。
情報が正しくても進歩の早い分野では古くなっている可能性は濃厚です。
参考になれば幸いですが、鵜呑みにせず正否や陳腐化の判断は自己責任でお願い致します。
目次
ボルナウイルスの起源は明らかになっていませんが、少なくとも一億年以上前と考えられているそうです。
最初にそれらしき症状として記録に残るのは1767年、対象動物は馬。
それから100年以上経過した1885年(明治18年)に欧州の騎馬隊で確認され、1890年にかけて大流行します。
場所は現在でいうところのドイツ連邦共和国ザクセン州ライブツィヒ地区の首都ボルナ(Borna)。
ボルナはベルリンや国境に近く、交易路や戦略的にも要所だったのでしょう。
騎兵隊が多くいたこの街で軍馬に奇妙な運動障害が発生と報告があり、そこから瞬く間に広がったとされます。
その後この病には街の名称に因んだボルナ病と名付けられました。

首都ボルナから北東に約170kmの場所にはACTPが所在します。
ACTPはAssociation for the Conservation of Threatened Parrotsの略。
インコの絶滅危惧種の保全に興味があれば必ずその名を知るような社団法人です。
非公開の施設ですが、アオコンゴウインコ、コスミレコンゴウインコ、イロマジリボウシインコ、オウボウシインコなど垂涎種が揃い踏みです。
1885年 ボルナウイルスが騎馬隊で発生
1898年 牛の口蹄疫とタバコモザイク病の病因物質として初めてウイルスの存在が発見
1924年 ボルナ病を発症した馬の神経組織をウサギの頭蓋内に注射することで人為感染に成功
1926年 ボルナウイルスが同定される
1966年 国際ウイルス分類委員会 International Committee on Taxonomy of Viruses :ICTV 設立
1985年 人に対する最初のボルナウイルス臨床報告。人での疾患の関連性が示唆されたことを期に研究が加速
1990年 ゲノムの単離(さまざま混ざり合った中から特定して分離すること)に成功
1996年 ICTVはボルナウイルス属とボルナウイルス科の新設を提案
2008年 PDDの病因物質としてトリボルナウイルスが同定
2015年 人で初めてのボルナウイルス感染確認がされる。VSBV-1による致死性脳炎によって死亡症例
当初は馬や羊の病気と考えられていましたが、哺乳類、鳥類、爬虫類、魚類など様々な動物でボルナウイルスが確認されています。
人獣共通感染症(ズーノーシス)とは
動物から人へ感染する病気は総称として人獣共通感染症(Zoonoses|ズーノーシス)と呼ばれます。
白血病の発見などで知られるドイツのRudolf Virchow博士による造語で、zoon(動物の) -osis(病気)です。
主な病原体はウイルス、リケッチア、クラミジア、細菌、真菌、原虫および寄生虫です。
WHOによると2020年の現時点で200種以上とされており、今後も増加していくことでしょう。
日本での位置づけ
日本での正式名は厚生労働省によって動物由来感染症として定められています。
患者を診断した医師は、直ちに保健所などに届け出なければなりません。
感染症は感染症法(感染症の予防及び感染症の患者に対する医療に関する法律)によって、危険度1~5類に分類されています。
ボルナウイルスは2020年の現時点において指定されていません。
愛鳥に関わるものとしてはオウム病クラミジア(Chlamydophila psittaci)があります。
鳥から人に感染すると突然の発熱で発病し、処置が遅れると死亡するケースもあります。
このオウム病クラミジアは4類感染症に分類されています。
4類感染症の定義は「人から人への感染は殆どないが、動物、飲食物などの物件を介して人に感染し、国民の健康に影響を与えるおそれのある感染症」。
1類感染症の定義は「危険性が極めて高いとされる感染症」。
エボラウイルス病(エボラ出血熱)などが指定されています。
エボラウイルスはモノネガウイルス目に分類されるRNAウイルスで、狂犬病ウイルスやニューカッスル病ウイルス、そしてボルナウイルスも含まれます。
人獣共通感染症のボルナ病ウイルス
人獣共通感染症として確認されているボルナウイルスは2020年1月の現時点では2種類です。
●ボルナ病ウイルス1型
Borna disease virus 1: BoDV-1
●カワリリスボルナウイルス1型
Variegated squirrel bornirus 1: VSBV-1
ボルナ病の感染患者は殆がヨーロッパに限定されています。
ただし日本にも無症状の感染者が存在する可能性が高いと考えられているようです。
カワリリスボルナウイルスによる人の感染死
2015年にドイツ東部で住民3名の奇妙な死亡報告がありました。
3名とも親交のある高齢者(63,62,72歳)で、次々に原因不明の致死性脳炎を発症して死亡しました。
症状は、発熱ふるえ、沈鬱、錯乱、行動異常、歩行困難、ミオクローヌス、眼球運動麻痺、昏睡など
3名には様々な検査が行われましたが、存命中に病原体は検出されませんでした。
しかし3名には原因として疑わしい共通点がありました。
いずれも中米に分布するカワリリス(変わり栗鼠|Sciurus variegatoides)の愛好家でした。
その後、フリードリッヒ・レフラー研究所(FLI/ドイツ連邦動物衛生研究所)がボルナウイルスを検出。
カワリリスボルナウイルス(VSBV-1)として同定され、咬傷から感染したと考えられています。

トガリネズミ/シロハラジネズミ由来
自然界で細菌やウイルスと共生している宿主を自然宿主と呼びます。
宿主に対しては無害ですが、他の動物に感染すると疾病の原因になる場合があります。
ドイツでの調査で、ボルナ病ウイルス(BoDV-1)のホルダーでありながら症状が無く、糞尿や唾液からウイルスを排出するネズミが確認されました。(Bourg M)
トガリネズミ科 ジネズミ属 シロハラジネズミ(Crocidura leucodon|英:Bicolored shrew)
この種や近縁種がBoDV-1の自然宿主としての可能性が有力と考えられています。
2018年には1人の脳死者から提供された腎臓と肝臓の移植をうけた3人がともに致死的な脳炎を発症し、2名が死亡しました。
3名からはドナーの居住地域に分布するトガリネズミが保持するボルナ病ウイルスらしきが検出され、臓器移植で感染したと考えられています。

トリボルナウイルスは人獣共通感染症?その1
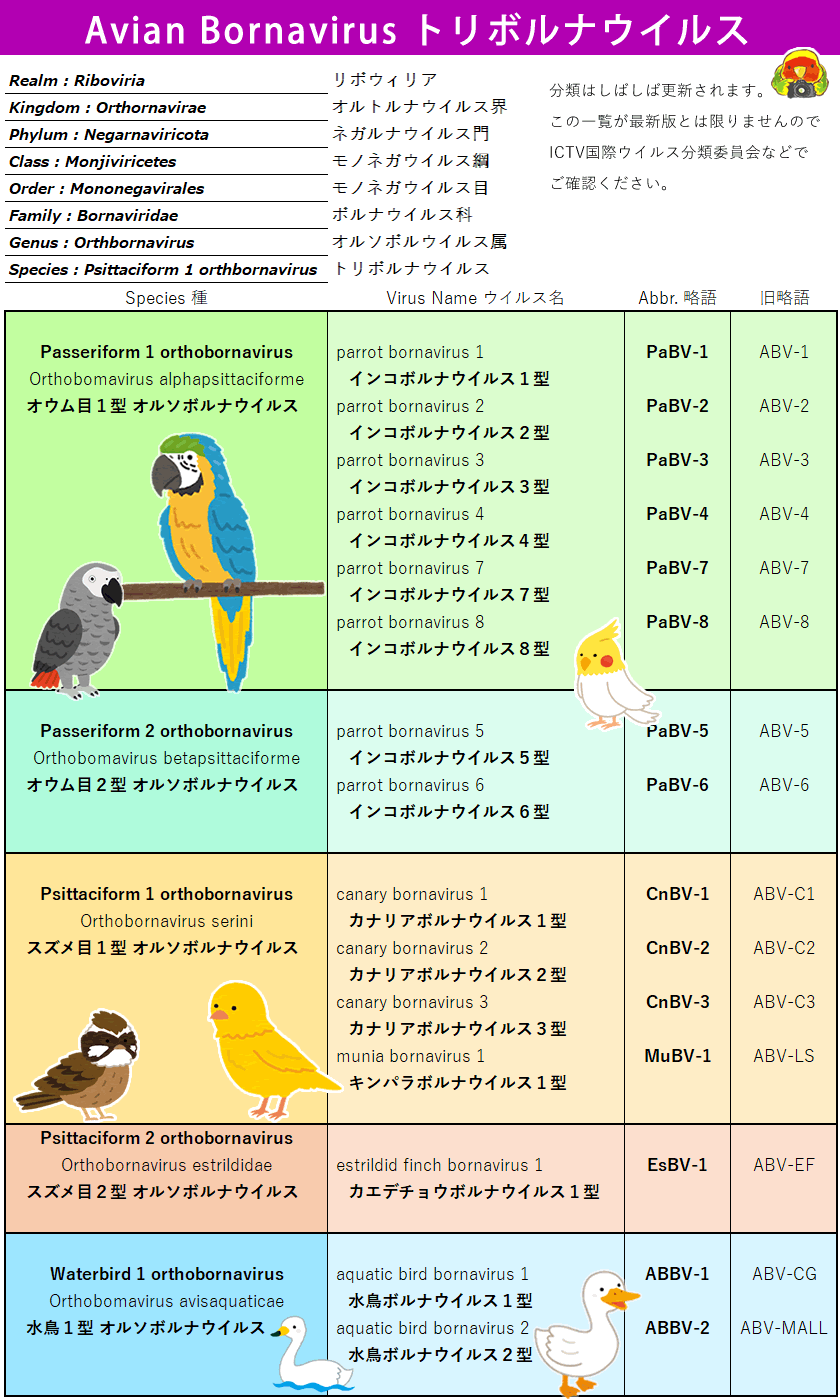
トリボルナウイルスは現状で3種に大別されます。
●オウム目ボルナウイルス|PaBV
●スズメ目ボルナウイルス|CnBV
●水鳥ボルナウイルス|ABBV
定説ではトリボルナウイルスは哺乳類で増殖出来ないため、人獣共通感染症ではありません。
しかし、最新の研究ではスズメ目と水鳥のボルナウイルスはそうでもないような報告があります。
トリボルナウイルスは人獣共通感染症?その2
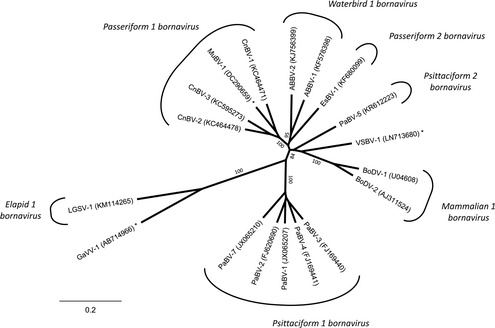
スズメ目と水鳥のトリボルナウイルスは人獣共通感染症の潜在性がある。 という記載を2014年にボルナウイルス研究の先端である京都大学 朝長研究室の牧野晶子氏がされています。 ボルナウイルス属はゲノムの解析により3つのクレードに大別することが出来ます。 Clade11️⃣哺乳類1ボルナウイルスBoDV-1,BoDV-2,VSBV Clade22️⃣スズメ目1ボルナウイルスCnBV-1 Clade22️⃣スズメ目2ボルナウイルスCnBV-2 Clade22️⃣水鳥ボルナウイルスABBV Clade22️⃣オウム目ボルナウイルスPaBV-5 Clade33️⃣オウム目ボルナウイルスPaBV-1,-2,-3,-4,-7 これら3つのクレードのうち 哺乳類のクレード1とスズメ目&水鳥のクレード2は近縁であることが解明されています。 培養細胞による実験を行った結果として CnBVスズメ目ボルナウイルス1型とEsBVスズメ目ボルナウイルス2型は哺乳類へ感染性を示した。 PaBV-2,PaBV-4のオウム目ボルナウイルスでは感染性を示さない。 この結果からスズメ目と水鳥のトリボルナウイルスは人獣共通感染症になりうる潜在性があるということです。 オウム目ボルナウイルスには潜在性は無いとされますが、PaBV-5がクレード2に含まれているのは気になります。 とはいえ、一般的な飼育環境下でのリスクは限りなく無いに等しいだろうとは思います まだまだ未知の分野であり、今後の研究に注目です。

ボルナウイルスは狂犬病ウイルスやエボラウイルスはモノネガウイルス目に分類されます。 他のRNAウイルスとは一線を画する特殊な存在です。 塩基数≒8900の一本鎖マイナス鎖RNAをゲノムにもちます。 RNAウイルスとしては非常に特殊な感染様式をもち、細胞核で持続感染します。 ボルナウイルスは神経細胞に感染します。 神経細胞は排除されにくくて寿命も長く、宿主に長期間持続感染することが可能。 神経指向性をもち、末梢神経から中枢神経系にシナプスを介して伝播することが可能。
トリボルナウイルスが発見されたのは2008年 PDDを発症したコンゴウインコから病因物質として同定されたウイルスです。 この発見によって単一属と考えられていたボルナウイルスが再編されることになりました。 その後、スズメ目や水鳥などで新しいトリボルナウイルスが同定されます。 2014年~2019年で5回の分類変更がなされました。

ボルナウイルスに起因する疾患をボルナ病と呼びます。 ボルナウイルスが中枢神経に感染する神経系疾患です。 中枢神経からの体性神経や自律神経に作用することで症状が発生します。 ダメージを受けた神経が不調を起こすことで症状が発生します。 体性神経とは骨格に分布して随意的な運動を司る神経で、自分の意思で制御出来ます。 体性神経には感覚神経と運動神経の2つがあり、視覚や聴覚に味覚、筋肉をつかって身体を動かしたりなどです。 要は自分の意志に沿った動きをする神経です。 自律神経とは交感神経、副交感神経で、内臓に分布して付随的な運動を司る神経です。 交感神経でよく例えられるのは、自動車でいうアクセルに相当し、心臓の動きで血液の流れをコントロールします 副交感神経とは自動車でいうブレーキに相当します。 ボルナ病を発症すると、沈鬱、行動障害、内臓障害、繁殖障害などを引き起こします。 症状は動物や個体によって様々ですが、致命的な脳炎を引き起こすこともあります。
1985年に人の精神疾患におけるボルナウイルス大規模調査が行われました。 その調査以降に積極的な研究が進められています。 2008年にトリボルナウイルスが発見されました。 トリボルナウイルスの発見以降はステージが変わり、多様なエキゾチックアニマルからの同定が続いています。 2020年時点でのウイルスの研究において、ボルナウイルスは非常にホットな研究分野です。
ボルナウイルスが原因と考えられていたネコの疾患「よろよろ病(staggering disease)」。
ルストレラウイルスの関連であることが2023年2月のNature Communicationsで発表されました。
ヒトにも感染する風疹ウイルスと近縁で、有袋類やカワウソ、ロバなどなどでも確認されています。
トリボルナウイルス感染症による総じた病名をCBL真田先生による表記「鳥ボルナ病」に準拠します。
- トリボルナウイルス(Avian Borna Virus : ABV)
- トリボルナウイルス感染症(Avian Bornavirus infection)
- トリボルナウイルス性神経節神経炎 (Avian Bornaviral Ganglioneuritis : ABG)
・トリボルナウイルスの分類は現時点において オウム目型3系統8種、スズメ目型2系統5種、水鳥型1系統2種が分類される。 ・鳥ボルナ病はトリボルナウイルスが神経組織に感染することで引き起こされる致死的な消耗性疾患/免疫性疾患です。 ・主に消化器症状および神経症状が多く、進行性の体重減少、衰弱死がみられる。 ・様々な症状を示す。(症状は後述) ・陽性であっても無症状のまま発症しない場合も多いと推察されている。 ・感染経路は糞便や接触唾液などで空気感染は確証がない。 ・飼鳥界において蔓延しているのか実態は不明。 ・PBFD(サーコウイルス)、BFD(ポリオーマウイルス)に比べて症状からの特定が難しい。 ・陰性証明の信頼性は低く、 ・発症は年齢や性別を問わない。 ・現時点で有効な治療方法はない。 ・二次感染に対する対処療法が推奨される。
鳥類のトリボルナウイルスは世界中で多数確認されています。 2009年には飼育下と野生下の約80種から確認されました。 ブラジルの野生下で確認された陽性のインコについては、リハビリセンター収容時に感染し、野生下に再放出されたことで広がっている可能性が指摘されています。
2020年にブラジルの2箇所の繁殖施設(A.商業飼育施設とB.自然保護飼育施設)での調査
オウム目21種38羽を剖検
全体の73.7%でPaBV感染が検出
Aでは66.7%が臨床症状を示し、88.9%がPaBV陽性
Bでは27.6%が臨床症状を示し、69%がPaBV陽性
両施設で遺伝子型4(PaBV-4)が蔓延
調査された鳥の約15.8%は絶滅危惧種
シロハラインコ、タイハクオウム、アオアケボノインコ、アケボノインコ(ドイツ由来)、ヨウム(カナダ由来)、キエリヒメコンゴウインコ(USA由来)、コンゴウインコ(USA由来)、ルリコンゴウインコ(ドイツ由来)、キバタン(スイス由来)、ヨウム(ドイツ由来)
アカオボウシインコ、キボウシインコ、テツバシメキシコインコ
主に、直接接触、糞便摂取、乾燥糞や羽埃からのエアゾル吸引の可能性が示唆されています。 定説として、トリボルナウイルスの感染力は弱く「鳥同士の長期にわたる密接な接触が必要」と考えられています。 傷口からの水平感染も経路の可能性がある。
垂直感染
親鳥から卵への垂直感染が確認されています。(Dahlhausen) PaBV-4に感染鳥(オカメインコ)が産んだ発育卵にウイルスが検出された。 オカメインコで92コの卵を17日目まで培養し、で約45%が陽性(分岐した様々なケースをざっくり主観でまとめての値) 成体と幼体にグループにわけて行った結果、感染時の鳥の年齢は垂直感染の発生に重要な要素である可能性がある。 水鳥ボルナウイルスに陽性のカナダガンが産んだ卵から孵化したヒナへの垂直感染が調査され、否定的な結果となっている。Journal of Avian Medicine and Surgery vol.26 垂直感染は確実ではないが、確率は低くは無い模様。
タイで飼育下のオウム目231羽を対象にした調査。
オウム目231羽は5つの地域から3科(オウム科、ヨウム科、インコ科)の25種。
5つの地域の内訳は、バンコク、ナコンパトム、パトゥムターニー、コンケン、ソンクラー
25種の内訳は、タイハクオウム、キバタン、オオバタン、オカメインコ、ボタンインコ属、オオハナインコ、ショウジョウインコ、セキセイインコ、アオボウシインコ、キソデボウシインコ、ルリコンゴウインコ、ベニコンゴウインコ、コンゴウインコ、ヒメコンゴウインコ、クロガミインコ、コガネメキシコインコ、ヒオウギインコ、コミドリコンゴウインコ、ズグロシロハラインコ、ズアカハネナガインコ、キエリヒメコンゴウインコ、ダルマインコ、オオホンセイインコ、ヨウム、ホオミドリウロコインコ
PCR法で13.85%(231羽中の38羽)からPaBV-2またはPaBV-4を陽性検出。
陽性反応を示したうちの81.58%(38羽中の31羽)は無症状。
陽性を示した種は6種。
6種38羽の内訳は、タイハクオウムx2、オオハナインコx1、ルリコンゴウインコx3、コガネメキシコインコx30、コミドリコンゴウインコx1、ヨウムx1
無症状を示した31羽は2種で、内訳はタイハクオウムx2、コガネメキシコインコx29
PaBV-2のPaBV-4内訳は、PaBV-2のコガネメキシコインコx3以外はすべてPaBV-4
以前の調査ではPaBV-5も検出されている。
陽性を示した38羽の出処は5つの地域すべてを含む。
陽性かつ臨床症状を確認されたのは5種7羽。
5種7羽の内訳は、
・オオハナインコx1 神経学的
・ルリコンゴウx3 神経系、消化器系
・コガネメキシコx1 消化器系
・ヒオウギインコx1 消化器系
・ヨウムx1 消化器系
231羽中の204羽は無症状であったが、27羽は運動失調、衰弱、麻痺、体重減少、排泄物中の未消化飼料、前胃肥大が確認された。
陽性反応を示して臨床症状を確認された7羽とは20羽の違いがある。
それらがPaBVの誤陰性とは限らないがPCR検査による検出は完全ではない。
PMCID: PMC12604982 PMID: 41016751
まだまだ調査数が少ないという前提においての数値です。 推測では飼育下の鳥の10%から45%が感染しており、健康な飼育下のオウムの少なくとも3分の1がボルナウイルス陽性である可能性があるともいわれます。(数値の根拠は弱いように感じるが、実際に多い) 陽性の鳥は増え続けているが、臨床症状の鳥は少なくなっているとも言われます。 臨床疾患の発生率が低く、重篤な疾患の発生率はさらに低いことも考慮しなければなりません。 Lierz Mの研究によると採取したサンプルからの検出率は34.3%で、高ストレス下で飼育場で100羽以上を検査した中では52%、2012年には別の高ストレス飼育所で71%の陽性率であったとされています。 2011年の調査では、80羽のうち33%がPCRで陽性。50%以上が抗体をもっており、PCRでは陰性。という興味深い結果。 ブラジルの診療所および繁殖施設からの32羽のボルナウイルス陽性鳥の調査では、違法取引から没収された数羽を含め、苦しんでいる鳥の66%がCNS症状を示し、22%がGI徴候を示し、9%が死亡。 ボルナウイルスは場所によっては高い感染性を示すことが観察されていますが、ウイルスの拡散の実験室試験では、特定の信頼できる感染経路はまだ特定されていません。
サンプル数が少なく偏りが出てしまうだろうという想定を踏まえた上での感染率。 Dahlhausen R, Orosz S.によると 発症例の多い種 オウム、ボウシインコ、オオハナインコ、ヨウム、コンゴウインコ 発症例の少ない種 オカメインコ、セキセイインコ、アケボノインコ、コニュア CBL真田先生による2017~2020の検査結果では、高いものから順に オオハナインコ、コニュア、ボウシインコ、アケボノインコ、モモイロインコ、オウム、オキナインコ、コンゴウインコ、ヨウム、ハネナガインコ、キキョウインコ、オカメインコ、ラブバード、シロハラインコ 症例の無いものとして、セキセイ、マメルリハ、サザナミ、ホンセイ、ローリー あくまで主観としては、PDDが元々コンゴウインコ特有の疾患と考えられていたのはスタミナやサイズが大きくてわかりやすく、検査や検死にお金を掛ける率も高いからこそ気付かれていたのだと考えており、現状を見るに感受性に程度の差こそあれ、おそらくオウム目の殆どで罹りうるのではないかと考えています。
トリボルナウイルスは長寿命の細胞である神経細胞に定着します。 タイハクオウム、オオバタン 、 アカコンゴウインコ 、 ナナイロメキシコインコでの調査によると、一人餌になっていないヒナや免疫力が低下した個体は特に感染しやすく、推定潜伏期間は2~4週間と推定されています。(スミス&スキラー) 不活性化のまま数年、数十年、一生という場合もあるようです。
CBL真田先生による2017~2020の検査結果では、1歳~3歳、10歳以上の2つで山があり、間には谷間があるという興味深い統計があります。 ≦1ヶ月齢:0% ≦3ヶ月齢:3% ≦6ヶ月齢:6.7% ≦1歳齢:13% ≦3歳齢:15.9% ≦5歳齢:5% ≦10歳齢:9.1% >10歳齢:15.2% 垂直感染するとされているにも関わらずヒナヒナでは皆無、3ヶ月程度でも低い。 ヒナヒナ期に発症していれば漏れなく死亡しているのか、そもそも検査数が少ないだけかもしれません。 また、これらの陽性のうち約半数は無症状だそうです。
鳥ボルナ病の発症/活性化のトリガーはストレス、免疫力の低下が大きな要因。 キャリアが発症する最大の要因は過度のストレスと考えられています。 狭い場所に多数が押し込められた環境などもトリガーになりうる環境であり、1970年代のワイルド乱獲時代の大量輸送時に浸透したと考えられます。 * R. Dahlhausenは、臨床疾患の発症を次の素因に起因すると考えています。 遺伝学、年齢、関与する宿主種、および宿主の免疫系の発達能力または障害状態。 栄養失調、併発疾患、生殖活動、不適切な繁殖によるストレス。 ストレスは、ABG / PDDの活性化または再発の主要なトリガー。 * 親鳥は繁殖期に再発や新しい症状を引き起こす可能性があがるとされています。 活動状態と休眠状態を循環しており、ホルモン状態の増加によるストレスが免疫力を低下させて状況を悪化させると考えられています。 陽性であっても症状で苦しんでいるとは限らず、数年単位あるいは生涯を休眠で過ごすこともありえます。
トリボルナウイルスは神経細胞に定着します。 神経細胞は長寿命の細胞であることからトリボルナウイルスも長く存在することが可能になります。 進行は非常に早い場合もあれば遅い場合もあります。 活動状態と休眠状態を循環しており、ホルモン状態の増加によるストレスが免疫力を低下させて状況を悪化させると考えられています。
鳥ボルナウイルスを発症すると主に「行動障害」や「消化器不全」の症状が出やすいとされます。 症状は致命的な髄膜脳炎から些細な神経症まで幅が広く、進行速度も非常にムラがあります。 中枢神経の体性神経に影響をうけると「知覚神経」「運動神経」「混合神経」に関わる症状。 中枢神経の自立神経に影響をうけると「交感神経」「副交感神経」に関わる症状。
消化器系の筋肉の動きを制御する細胞が標的となりやすい。 腺胃といった胃腸の運動性が低下する機能障害 あくび、吐き戻し 食欲不振、体重減少/痩せ 宿便、未消化便、下痢
行動障害 運動失調 沈鬱 運動失調|ふらつき、脚力の低下、痙攣、麻痺、バランスをとれない 視力障害|目と脳の間の神経が感染し、視力低下や失明につながります。 自咬、自傷行為 攻撃的になる 認知障害 ほか多岐に及びます。
毛引きや自咬といった自傷行為は末梢神経炎によって発症する場合があります。 末梢神経炎は鳥ボルナ病による相関関係が確立されている。 2012年に毛引きのオオハナインコからトリボルナウイルスが検出されました。 毛引き鳥の54.4%と神経疾患の鳥の68.4%が鳥類ボルナウイルスの検査で陽性だったという研究結果。 ドイツの民間獣医診療所での126羽の鳥の研究では、他の神経学的兆候のない毛引き鳥で2番目に高いという調査結果
迷走神経は「炎症性反射、消化管病原体の侵入および組織損傷時の免疫応答および炎症を制御する神経反射」も制御します。 この反射が損なわれると、細菌の異常増殖に対する自然な抵抗が起こります。 これは腸内微生物叢(腸内フローラ)の変化と、ウェルシュ菌や真菌生物などの病原性生物の異常増殖につながります。 消化管通過の遅延によりウェルシュ菌と腸炎を発症します。
消化管や神経系だけでなく、体内のさまざまな組織を攻撃します。 肝臓、腎臓、副腎、心臓、肺でも発見されています。 心臓の右側には高密度の神経組織があり、一見正常に見える鳥の急性死をもたらすことがよくあります。 心臓は迷走神経によって神経支配され制御されており、影響を受けた鳥では右心室が拡大しています。 不整脈と血圧および心拍数の変化がみられます。
2022年10月現在において、PDD(Proventricular Dilatation Disease)の名称は古いものとなり
ABG(Avian Bornaviral Ganglioneuritis)、あるいは
AG(Avian Ganglioneuritis)に置き換わっています。
ABGはボルナウイルス由来における免疫介在性疾患で、腺胃拡張のような消化管や神経系をはじめ、影響を受けるすべての臓器やシステムを包括したものです。
AGはボルナウイルスを由来としたものではなく、別の原因で似た症状を発症しているものです。
金属アレルギー由来の腺胃拡張であればPDD/AGです。
なお、以下の解説は2020年1月に記したもので、ABG、AGに対応した更新は行っておりません。
PDDの概略
1970年代に南米のボリビアのサンタ・クルスから輸入された若いコンゴウインコで最初に症状が報告されました。 1978年にMacaw Wasting Disease(コンゴウインコ消耗性疾患)とされました。 1983年に名称をPDD(Proventricular Dilatation Disease/腺胃拡張症)と定められました。 2008年にPDD(腺胃拡張症)を発症したコンゴウインコから病因物質としてトリボルナウイルスが同定されました。 PDDの原因すべてがトリボルナウイルスだとは限りませんが、密接に関係することが裏付けられました。 PDDとは2つある胃の1つ目である腺胃が拡張して機能不全に陥る状態です。 腺胃の収縮を司る神経がダメージを受けて収縮力が失われると腺胃は拡張します。 そのダメージにトリボルナウイルスが関与している場合は鳥ボルナ病におけるPDDとなります。 PDDの詳細はページをわけますのでそちらを御覧ください。
 PDD(Proventricular Dilatation Disease/腺胃拡張症)について
PDD(Proventricular Dilatation Disease/腺胃拡張症)について

オウムに対して最も毒性が強いと特定された遺伝子型はPABV-2およびPABV-4。
オカメインコでのいくつかの研究結果では、PABV-4がより神経学的な兆候に関連する。
PABV-2は主に胃腸管に影響を及ぼし、より重篤な疾患の進行を示した。
遺伝子型MuBV-1はオウム目には感染しない。
キンパラボルナウイルスMuBV-1はジュウシマツから発見された(東京農工大学 農学部共同獣医学科伝染病学研究室)。
MuBV-1はオウム目には感染しない。
ジュウシマツ、カナリアは感受性の高さが強く示唆されている。
2020年現在において、 飼育鳥からの調査で最も多く検出されている遺伝子型はPaBV-4型。 PaBV-4に感染させた復数羽のオカメインコで実験したところ、PDDを発症した個体と無症状の個体がいた。 PaBV-4はPDDの病因になりうるが、感染したからといって発症するわけではない。 PaBV-4を感染させたオカメインコと非感染とで同居させた実験では感染が確認されなかった。 ※期間やケージサイズは? PaBV-4に感染鳥が産んだ発育卵にウイルスが検出された。/感染率は未記載
PaBV-2を復数羽のオカメインコへ筋肉注射し、PABV-2の広がりを追跡した実験。 接種部位と隣接する神経、次に脊髄、そして最後に脳にウイルスが存在することが明らかになった。 114日間の実験で、ウイルスは胃腸系、副腎、心臓、腎臓にも広がった。 PABV-4でもPABV-2と同じく検査で陽性となった多くの鳥が症状を示さないこともよく知られている。
・生前検査は難しい ・PDDの検査についてはレントゲン ・「複数の糞」からの検査、後鼻孔と総排泄腔のスワプ検査、血液 ・ウイルスが糞に排出される頻度は間欠的である場合が多く、数日分をまとめた糞での検査が必要 ・検査にはごく一部分を検査するため、糞の量が多くなるほど疑陰性の可能性は高まる ・確実性を高めるには、数日分をまとめた糞検査の回数を増やすのが現実的 ・無症状であったものが通院や血液検査などで過度にストレスがかかって発症ということも無くはない
現時点で有効とされる治療方法は確立出来ていません。 トリボルナウイルスを自身の免疫で排除/排出することは出来ない(自己免疫反応が関与している可能性) SLClubb,M.Meyerの説では、陽性の鳥は病気に対して自然な免疫を持っている可能性がある。 これまでに回復したものは殆どが臨床的に罹患した鳥である。 陰転とは計測限界値以下であって、完全排出とは限らない。 研究のブレイクスルーが期待されます。
模索としての薬物療法で幾つか使用されています。
ボルナ病ウイルス1型(BoDV-1)を計測限界以下に低下。
ファビピラビル(T-705)の効果を再び試験し、比較的高用量ではあるが、哺乳類と鳥類の両方のボルナウイルスを減少させることを観察した。
精神活動改善・パーキンソン症候群治療剤, 抗A型インフルエンザウイルス剤
セレブレックス(10mg / kgを1日1回経口投与を6〜12週間)では首尾よく治療された。 Dahlhausen etal 2002
苦しんでいる鳥には毎日20 mg / kgの経口投与量を使用することを推奨していますが、一部の鳥の胃腸出血の副作用とスミレコンゴウインコで薬剤に対する過敏症の発症をもたらしたことを報告。
腎疾患のある鳥にはNG。
不明な点も多い。
しかし、抗炎症薬の使用は批判されており、セレブレックスとメロキシカムを使用することの有効性はあるとしても限られているとも指摘があります。
胃腸の炎症および出血という深刻な副作用の可能性。
また、オカメインコのメロキシカムによる治療では、症状を悪化させたことが報告されています
PDD症例でのNSAID(セレブレックスとメロキシカム)の使用は直ちに中止されるべきであるという指摘もあります。
抗炎症薬の使用はまだ議論中。
臓器移植で拒絶反応を防ぐためにヒトで使用される免疫抑制剤のシクロスポリンの使用は、体内に大量のウイルスが残っているにもかかわらず、オカメインコの臨床症状の軽減をもたらされた。
広範囲のRNAウイルスにわたるRNA複製を減少させる薬剤であるリバビリンの効果を調査し、哺乳類細胞と鳥類細胞の両方で培養細胞に対してウイルス複製を減少させたが、ウイルス排除はしなかった。
インターフェロンとの組み合わせることで薬剤単独と比較して抗ウイルス効率が大幅に向上。
*
生後約6ヶ月の健康な10羽のオカメインコにおけるリバビリン長期投与(12週間)による安全性実験において副作用の臨床的兆候は認められませんでした。2025.11/3 Safety of ribavirin in cockatiels (Nymphicus hollandicus) – a preliminary study
哺乳動物におけるサイトカインファミリーの一種
免疫系の調節を助ける
培養細胞で効果的
Robert D. Dahlhausen博士によると ・ボルナウイルスは他のRNAウイルスよりも環境中で安定している。 ・宿主の外で存在出来る限界時間は8時間とされる。 ・摂氏56℃で急速に感染力が低下する。 ・紫外線に弱く、漂白剤や一般的な消毒液でも効果的に無効化できる。 ・簡単に空気感染するようなものではなく、一般的な消毒液も効果的とされている。

いまひとつ疑問に感じますが、研究はその後も大きく進んでいるでしょうから内容も更新されているかもしれません。
- Companion Bird Laboratories(CBL)
- 京都大学 朝長研究室
- 京都大学 ウイルス研究所 ヒトがんウイルス研究分野
- オルソボルナウイルスの膜糖蛋白質の発現調整による戦略的粒子産出機構とその応用|京都大学 酒井まどか
- ボルナウイルスに関する臨床研究のレビュー|地方独立行政法人大阪府立病院機構
- 改訂 ウイルス分類話題のウイルスの知見と動向|緒方靖哉|九州大学名誉教授
- 改訂 ウイルス分類 – 化学と生物
- ヒトにおけるボルナウイルス感染症の実態とその病態
- JBSA Newsletter Vol.6 No.1 April 2016 (No.15)
- 日本ウイルス学会 第62巻 第2号 2012年12月
- NIID 国立感染研究所
- ICTV : Bornaviridae Table of Contents
- Avian Bornaviral Ganglioneuritis: Current Debates and Unanswered Questions
- Antiviral activity of Favipiravir (T-705) against mammalian and avian bornaviruses
- Bornaviridae_wikipedia
- Understanding Avian Ganglioneuritis
- Birds and bornaviruses
- Are anti-ganglioside antibodies associated with proventricular dilatation disease in birds?
- Retrospective study of PDD (Proventricular Dilatation Disease) incidence in Psittacine birds from Barcelona Zoo
- Avian bornavirus in the urine of infected birds
- Occurrence of avian bornavirus infection in captive psittacines in various European countries and its association with proventricular dilatation disease
- Schubot researchers image Avian Borna Virus
- Recombinant Modified Vaccinia Virus Ankara (MVA) Vaccines Efficiently Protect Cockatiels Against Parrot Bornavirus Infection and Proventricular Dilatation Disease
- Avian Borna Virus in Psittacine Birds / PDF
- The Macaw Society コンゴウインコ協会
- Advanced Diagnostic Approaches and Current Management of Proventricular Dilatation Disease *
- Kistler A.L., Gancz A., Clubb S. Recovery of divergent avian bornaviruses from cases of proventricular dilatation disease: identification of a candidate etiologic agent. Virol J. 2008;5:88. [PMC free article] [PubMed] [Google Scholar]
- Honkavuori K.S., Shivaprasad H.L., Williams B.L. Novel borna virus in psittacine birds with proventricular dilatation disease. Emerg Infect Dis. 2008;14(12):1883–1886. [PMC free article] [PubMed] [Google Scholar]
